恶性贫血病人对重组体人促红细胞生成素(rHuEpo)治疗反应的预测
HAEMATOLOGICA、JOURNAL OF HEMATOLOGY
Vol.81,number5,September-October1996
背景:
部分贫血并伴有尿毒症的病人经过EPO(促红细胞生成素)治疗后都有所反应,用一种可靠的方法预测潜在的治疗反应者和无反应者将是十分有益的.
材料与方法:
我们回顾性地检阅了58名有各种恶性混乱的难治性贫血病人,这些患者均经皮下注射EPO治疗。用375U/kg的EPO剂量先治疗四周后,如果经观察没有反应,第二个四周剂量增加到750U/kg,如果血红蛋白增加≥2g/dL则认为治疗有反应不必输血。我们观察了各种不同的实验室指标(基准线水平,两周和四周的变化)来作为治疗反应的预测。通过血清中EPO的水平来评价内源性红细胞生成素的产生。通过网织红细胞计数和可溶性转铁蛋白受体评价红细胞系的活性。
结果:
经过对48人的评价,用EPO治疗八周后, 58%有所好转。 多元回归分析显示:血清基准EPO水平和两周后转铁蛋白受体的变化可解释53%患者八周后血红蛋白浓度的变化。根据这两个参数,得出对个体患者的治疗反应预测的敏感性为96%,特异性为79%,总准确度为88%.另外58%患者血红蛋白浓度八周后的变化,可根据四周后的血红蛋白浓度和网织红细胞的变化来解释。使用这两项参数和基准EPO水平,得出对个体患者的治疗反应预测的敏感性为92%,特异性为82%,总准确度为88%。
结论:
该回顾性分析提示治疗前血清中EPO水平和早期的实验参数变化可合理地预测EPO治疗的反应。
全世界有超过300,000的病人需要EPO治疗肾衰竭引起的贫血,如果能给予适当的治疗,超过95%的病人对EPO治疗有反应。相比起每个月输2-3次的血,用EPO每周≤100U/kg治疗贫血病人更经济有效,而且能明显改善严重贫血患者的生活质量。
除了尿毒症以外仅一部分贫血的病人经EPO治疗有效,对治疗有反应的个体范围从骨髓增生异常综合症的16%到多发性骨髓瘤的将近70%,以及内源性EPO产生的缺乏与对EPO治疗反应的可能性之间的联系。
重组体促红细胞生成素(rHuEPO)是一种昂贵的药物,而花费的限制是现在医疗政策中的主要问题。预测潜在的反应者和无反应者的可靠的方法将被临床应用于非肾性贫血。因此我们回顾了应用rHuEpo治疗的58名肿瘤患者的临床纪录。这项工作的主要目的是鉴别预测治疗反应者和对患者进行定位,而不是一种用rHuEpo治疗非肾性贫血进行疾病定位的方法。
病人和方法:
实验对象
rHuEPO在由血液学紊乱和实体瘤引起的难治性贫血治疗中的应用已获得意大利Pavia医学院国际药品和医学治疗伦理委员会的批准。所有的患者均给予通知并征得同意。
我们连续给出了用rHuEPO 治疗的58名血红蛋白浓度低于10g/dl的由各种紊乱引起的难治性贫血患者,9名骨髓增生异常综合症(MDS),18名多发性骨髓瘤,11名非霍奇金淋巴瘤,20名实体肿瘤。
在研究过程中使用的rHuEPO由 德国曼海姆市Boehringer Mannheim GmbH公司提供。治疗协议是一项采用先前在I-II阶段临床试验的修改稿。对门诊病人每日一次经皮下注射,一周五次。该药物可由自己注射或由相关人员或私人护士给予。最初四周使用为375U/kg如果没有反应,后四周增加到750U/kg.为达到最佳利用价值而不浪费,每一份剂量都经过校准.如果血红蛋白增加大于2g/dl,则不必输血.
实验调查
每周进行血细胞计数。网织红细胞计数与贫血相关。通过检测血清铁、转铁蛋白饱和度和铁蛋白来评价体内铁的情况,除病人血清铁大于150μg/dl和/或转铁蛋白饱和度大于60%外,均给予日常口服铁剂(亚铁硫酸盐,100mg/天)。
血清中EPO水平可通过商品化的放免试剂盒测定,根据EPO的水平可以区分贫血的程度。在参考人群中检测血清EPO对网织红细胞(Hct)的回归方程,确定95%可信区间。根据回归方程,得出每个样本的检测值/预期值Log(epo)比率(O/P 比率)。在参考人群中平均O/P 比率为1.00±0.11(95%可信区间:0.80 – 1.19)。
评价红骨髓活性的转铁蛋白受体(TfR)可通过多克隆抗体检测.对165个正常对照组的检测,平均水平5.0±1.1 mg/L,95%可信区间为2.9-7.1mg/L。
统计分析:
使用有关统计软件储存、分析和报告数据,所有的计算都在一部 Macintosh Quadra 650 (苹果计算机公司) 个人电脑上运行。除非有其他说明计算结果用平均值±1SD表示。各组数据间用T检验和/或F检验(变异分析)评价任何显著差异的可能性。Chi-square 分析用于决定两个参数是否相关。多元回归分析被用于研究各种实验室参数作为rHuEpo治疗反应的预测价值(基线水平,两周和四周的变化)。
定义
采用以下定义用于有关治疗反应的预测:

结果
有10人被取消,剩下的48人参加评估,有58%患者在8周治疗后有反应。实验数如下表1。
内源性EPO的产生及rHuEPO治疗的反应
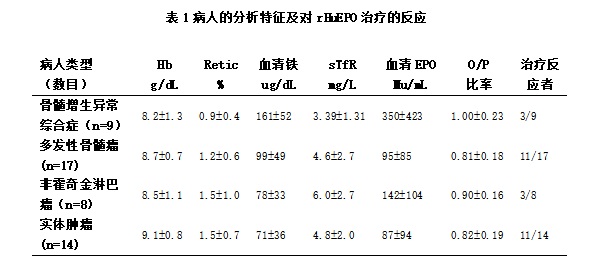
八周后DHb(D表示对应于基准值的变化)与血清基准EPO O/P比率呈负相关(r=-0.57;P<0.001)(图1)。
此外,血清EPO<100mU/mL的患者中25/31名患者对治疗有反应。然而血清EPO>100mU/mL的患者中仅3/17名患者对治疗有反应(X2=10.1;P<0.01)。
治疗2周和4周后Hb、网织红细胞计数、和sTfR的变化与治疗反应之间的联系
8周后Hb增量与两周后TfR的变化直接相关,(r=0.68;p<0.001) (图二);24/26名患者两周后TfR增加≥25%的对EPO治疗8周后有反应,只有4/22名患者两周后∆TfR≤25%的对EPO治疗8周后有反应(X2=16.3;P<0.001)。两周后Hb变化与8周后Hb增加关系不明显(r=0.38;p<0.01), 8周后Hb增加与两周后网织红也没有必然联系.
8周后Hb的增量不仅与4周后TfR的变化(r=0.70;p<0.001)密切相关而且也与四周后网织红和Hb水平变化密切相关(r=0.68;p<0.001) (图三) 。
多元回归分析评价各种实验指标(基准值,2周和4周后的变化)作为EPO治疗反应的预测价值
使用基准值和2周后变化的多元回归分析显示:基准O/P比率和2周后TfR的变化是EPO治疗反应的独立预测指标。实际上根据这两项参数的变化可解释53%患者8周后Hb变化(校正后的多元回归r=0.73;p<0.0001)。
8周后DHb对基准值和4周后变化的多元回归方程显示:4周后网织红和Hb浓度的变化可解释58%患者8周后Hb变化(校正后的多元回归r=0.75;p<0.0001)。
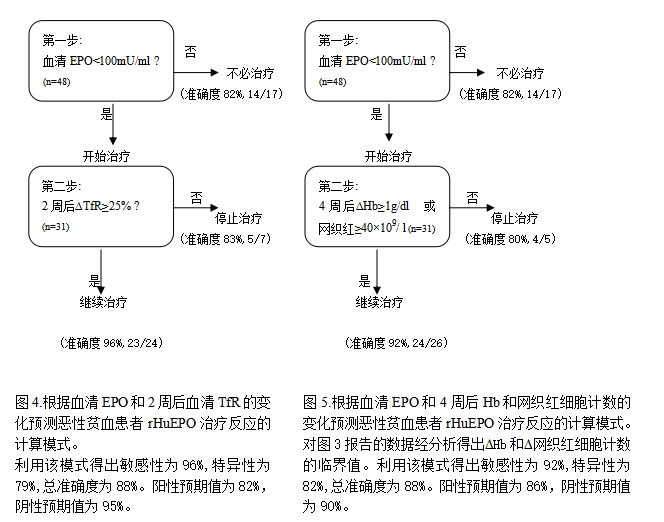
对rHuEPO治疗反应预测的计算模式
两种计算模式可以详细预测EPO治疗患者的反应情况。第一种计算模式是用基准血清EPO值(作为内源性EPO产生是否足量的指标)和2周后TfR的增量(作为早期治疗反应的指标)(图四)。利用该模式得出敏感性为96%,特异性为79%,总准确度为88%、。阳性期望值为82%,阴性期望值为95%。
第二种计算模式是用基准血清EPO值(作为内源性EPO产生是否足量的指标)和4周后Hb与网织红的变化(作为早期治疗反应的指标)(图五)。利用该模式得出敏感性为92%,特异性为82%,总准确度为88%,阳性期望值为86%,阴性期望值为90%
应该注意的是,集中化疗可暂时性地引起血清EPO的增加,在rHuEPO治疗前和/或治疗初期阶段立即接受化疗的患者可改变上述计算模式的预测能力。在周期性的化疗下,应排除个别人群可能引起的特异性和总准确度的增加。例如两种计算模式第一步的准确度有可能增加82%到100%。
讨论:
在当前的研究和先前的报道中,对EPO治疗反应的预测主要用于内源性EPO产生缺陷的病人。这些发现与EPO的生物学特性相一致,EPO通过阻止晚幼红和原始红细胞的凋亡主要引起红细胞增多症。因而当内源性EPO产生生理性增加时,红细胞激素不可能引起红细胞产生的增加。几乎所有有效的幼红细胞将存活并且不同于未成熟的红细胞。相比之下,由于贫血的不同程度使内源性EPO水平太低时,给予药物剂量的EPO可以防止一定数量的幼红细胞的凋亡,增加红细胞的产生。
少数报道指出血清EPO阈值≤100mU/ml时,预示EPO治疗有反应。在由Stenke的研究中, 用EPO治疗骨髓增生异常综合症(MDS)的过程中,治疗有反应的所有病人中除了一个其他血清EPO水平均<100mU/ml.Rose在用EPO治疗100个MDS病人,28%对治疗有反应,总共有86%(24/28)的治疗有反应患者血清EPO水平≤100mU/ml,Hellstrom从17项报道中分析了205名MDS患者,进一步证实血清EPO的基准水平是用EPO治疗的前提,由于血清EPO>100mU/ml时没有一名患者对EPO治疗有效。Cazzola用EPO治疗由多发性骨髓瘤和非霍奇金淋巴瘤引起的贫血患者。每周接受剂量为500U/kg/周或更多,已证实血清EPO水平是治疗有无反应的最好的预测指标。血清基准EPO水平≤100mU/ml时治疗后大约3/4的患者有反应。而>100mU/ml时治疗后不到1/5的患者有反应。
虽然使用O/P比率作为内源性EPO产生是否足量的测定可能更加精确,但是至少对于Hb<10g/dl的患者在预测性计算模式的第一步中采用100mU/ml的血清EPO临界值已提供了良好的临床应用价值(图四/五)。该指标的阳性预期值为82%,当在测定排除以前,如果他们立即接受化疗, 阳性预期值增加到100%。这提示在给予集中化疗后不应当立即分析血清EPO水平。低浓度的内源性EPO水平作为用EPO治疗反应的前提,但是也有一小部分患者例外。单纯性红细胞发育不全患者就是一个例外。
既然某些病人其血清EPO<100mU/mL时用EPO治疗无反应,那么就需要一项反映早期治疗反应的指标,让临床医生决定是否继续或终止EPO治疗。我们在第一个预测性计算模式中使用的第二项指标是2周后血清TfR的变化(图2),作为早期治疗反应的指标。血清TfR用于检测总骨髓红细胞生成的活性,Beguin et al 已在肾衰引起贫血病人中证实:该指标作为EPO治疗反应早期预测的有效性。在他们的研究中,当2周TfR增量≥20%,有反应为87%,当TfR增量<20%时有反应为48%,在当前的研究中,血清TfR 2周后的变化被证明是预测EPO治疗反应的十分有价值的指标, 2周后∆TfR≥25%的患者23例中只有一例对EPO的治疗无反应。
早期的研究已表明:2周后Hb的变化是EPO治疗反应的强有力预测指标。然而对接受输血和/或化疗患者该指标是无效的。2周后网织红的变化仅反映网织红的输出并不是红细胞生成的增加。通过对照发现4周后网织红增加到≥40×109/l与癌性贫血患者用EPO治疗反应呈正相关。已发现网织红荧光的增强预示MDS患者对EPO治疗有反应。在当前的研究中,4周后Hb和网织红的变化与EPO治疗反应有关并且有助于进一步简化预测的计算模式(图5)。虽然2周后血清TfR变化似乎是EPO治疗反应的最好指标,但是4周后Hb和网织红的变化似乎也有相同用处,不像TfR分析,后者被广泛应用而且也给出了另外2周治疗的理由;对病人而言足足一个月的EPO治疗也可能是比较合理的。
目前EPO通常只在特殊的情况下才被批准使用,但是医生的职责之一是能够对一般患者完成公共卫生政策到对个别患者的需要提供服务。我们也确信不管病情是否出现基础性混乱,使用EPO治疗的病人均应当受益。从表2的总结来看,已出现许多用于预测EPO治疗反应的指标。利用预测性可能允许对患者进行定位,而不是一种用rHuEpo治疗非肾性贫血进行疾病定位的方法。很明显这些计算模式必须重新定义(例如,治疗和有关化疗的实验调查时间是十分必要的)并在将来的前瞻性研究中进一步证实。
当和同事们讨论该项工作时,一部分人以一种轻蔑视的眼光看待我们的计算模式。我们认识到一些医生将争论这些仅仅是统计学的价值,不管所有的阴性预测数如何我们自己的患者很少对治疗有反应(图4和5)。他们中的一部分也可能叙述:他们在确定治疗缺乏反应时才中断EPO的治疗。问题是:他们在确定治疗无反应前EPO治疗持续的时间。一般而言,问题可能来源于患者或社会的观点。如果由后者支付治疗的费用,他可能了解使用的标准,EPO的使用可能使极少数患者处于不利的地位但是有助于许多,许多其他的患者。
表2:预测非肾性贫血EPO治疗反应的指标,预测性计算模式有可能使用这些指标对患者治疗方法进行定位。

![]()
文献
1. BergstrÖm J.New aspects of erythropoietin treatment .J Intern Med 1993; 233: 445-62
2. Barosi G.Inadequate erythopoietin response to anemia: definition and clinical relevance. Ann Hematol .1994; 68: 215-23.
3. Barosi G,Cazzola M, De Vincentiis A, Grossi A, Tura S.Guidelines for the use of recombinant human erythropoietin. Haematological 1994; 79: 526-33
4. Cazzola M,Ponchio L ,Beguin Y, et al.Subcutaneous erythropoietin for treatment of refractory anemia in hematologic disorders. Results of a phase I/II clinical trial. Blood 1992; 79: 29-37.
5. Ponchio L,,Beguin Y, Farina G, et al. Evaluation of erythroid marrow response to recombinant human erythropoietin in patients with cancer anemia. Haematologica 1992; 77: 494-501.
6. Beguin Y,Clemons G, Pootrakul P, Fillet G, Quantitative assessment of erythropoiesis and functional classification of anemia based on measurements of serum transferring receptor and erythropoietin. Blood 1993; 81:1067-76.
7. Schapira L, Antin JH, Ransil BJ, et al. serum erythropoietin levels in patients receiving intensive chemotherapy and radiotherapy. Blood 1990; 76: 2354-9
8. Stenke L, Wallvik J, Celsing F, Hast R. Prediction of response to treatment with human recombinant erythropoietin in myelodysplastic syndromes. Leukemia 1993; 7: 1324-7.
9. Ludwig h, Fritz E, leitgeb C, percherstorfe, M, samonigg H, Schuster J. Prediction of response to erythropoietin treatment in chronic anemia of cancer. Blood 1994; 84: 1056-63.
10. Cazzola M, Messinger D, Battistel V, et al. Rrecombinant human erythropoietin in the anemia associated with multiple myeloma or non-Hodgkin lymphoma: dose finding and identification of predictors of response. Blood 1995; 86:4446-53.
11. Koury MJ, Bondurant MC. erythropoietin retards DNA breakdown and prevents programmed death in erythroid progenitor cells.science 1990; 248: 378-81.
12. Wu H, Liu X, Jaemisch R, Lodish HF. Generation of committed erythroid BFU-E and CFU-E progenitors does not require erythropoietin , or the erythropoietin receptor. Cell 1995; 83: 59-67.
13. Rose EH, Abels RI, Nelson RA, McCullough DM, Lissin L. the use of r-HuEpo in the treatment of anemia related to myelodysplastic syndromes: a meta-analysis of 205 patients from 17 studies. Br J Haematol 1995; 89: 67-71.
14. Hellstrom-Lindberg E. Efficacy of erythropoietin in the myelodysplastic syndromes: a meta-analysis of 205 patients from 17 studies. Br J Haematol 1995; 89: 67-71.
15. Martelli M, Ponchio L, Beguin Y, Meloni G, Mandelli F, Cazzoal M. pure red aplasia following peripheral stem cell transplantation: complete response to a short course of high-dose recombinant human erythropoietin . Haematologica 1994; 79:456-9.
16. Beguin Y, Loo M, R’Zik S, et al. early prediction of response to recombinant human erythropoietin in patients with the anemia of renal failure by serum transferring receptor and fibrinogen. Blood 1993; 82:2010-6.
17. Beguin Y, Loo M, R’Zik S, et al. Quantitative assessment of erythropoiesis inhaemodialysis patients demonstrates gradual expansion of erythroblasts in haemodialysis patients demonstrates gradual expansion of erythroblasts during constant treatment with recombinant human erythropoietin. Br J Haematol 1995; 89: 17-23.
18. Henry D, Abels R, Larholt K. prediction of response to recombinant human erythropoietin (r-HuEpo/Epoietin-α) therapy in cancer patients. Blood 1995; 85: 1676-8.
19. Musto P, Modoni S, Alicino G, et al. Modifications of erythropoiesis in myelodysplastic syndromes treated with recombinant erythropoietin as evaluated by soluble transferring receptor, high fluorescence reticulocytes and hypochromic erythrocytes. Haematologica 1994; 79: 493-9.